Журнал «Клиническая лабораторная диагностика», декабрь, 2011г.
Павлов А.Е.1,2, Сейлиева Н.А. 1, Стефанов В.Е. 2
(1. ООО «Вега» Группа компаний «Алкор Био», Санкт-Петербург; 2. Санкт-Петербургский Государственный Университет, Санкт-Петербург.)
Аннотация
Значительное число людей в мире страдают от той или иной формы аллергии. Своевременная и точная диагностика аллергической сенсибилизации способна предотвратить осложнения и подобрать верный способ терапии.
За прошедший век выделены и охарактеризованы сотни специфических аллергенных субстанций, преимущественно в виде экстрактов.
С открытием в 1966 году иммуноглобулинов класса Е и объяснением их роли в формировании гиперчувствительности 1-ого типа стало возможным применение методов in vitro диагностики специфической сенсибилизации. Диагностические системы основывались на принципах ИФА на планшете. Появление и стремительное развитие микрочип технологии (microarray) в конце 20-ого века предоставило возможность проведения массового скрининга образца на сотни и тысячи маркеров. Данный метод представляется перспективным для проведения объемного и быстрого аллергоскринига.
Нами был создан прототипный образец тест-системы в формате микрочипа с 15 иммобилизованными аллергенами. Проведен анализ 16 образцов сывороток крови людей с аллергическими заболеваниями. Полученные данные показали высокую корреляцию с референтным аллергосорбентным тестом.
Формат анализа подразумевает прямую иммобилизацию аллергена на фазу, что делает большинство стандартных экстрактов не пригодными из-за наличия значительного количества неаллергенных «балластных» белков.
В большинстве своем, являясь близкородственными белками, некоторые группы аллергенов проявляют высокую кросс-реактивность, которая понижает специфичность диагностики.
Все это ставит вопрос о целесообразности и необходимости применения очищенных, либо искусственных аллергенных компонентов.
Результаты экспериментов подтвердили правильность сделанных выводов и выбор подходов.
Компонент-разрешающая диагностика в формате микрочипа позволит повысить специфичность и доступность анализа, что, несомненно, скажется на качестве жизни пациентов.
Ключевые слова: аллергия, диагностика, аллергоскрининг, микрочип, специфический IgE, рекомбинантный аллерген.
1. Введение
Более 25% людей во всем мире страдают от различных аллергических заболеваний [9]. Аллергические реакции I-ого типа относятся к немедленному типу гиперчувствительности, поскольку они появляются через несколько минут после контакта. Попадание аллергена на кожу и слизистые вызывает у больных аллергией классические симптомы астмы, ринита, конъюнктивита, синусита, покраснение и зуд. Показано, что развитие IgE-опосредованного иммунного ответа предшествует аллергическим проявлениям, следовательно, наличие спецIgE является фактором риска для развития симптомов аллергии [4, 1]. Более того, ранняя сенсибилизация является прогностической в отношении течения заболевания, тяжести его симптомов и развития других проявлений аллергии и атопии у детей [10,11,13].
Развитие IgE опосредованного иммунного ответа может проявляться как в легкой форме в виде чихания, кашля, слезотечения и зуда, так и в виде такого тяжелого, угрожающего жизни состояния, как анафилактический шок [7]. После первичного контакта с аллергеном иммунная система начинает вырабатывать IgE антитела против специфического антигена. Часть циркулирующих иммуноглобулинов класса Е связываются с рецептором на поверхности тучных клеток и базофилов. Повторный контакт организма с аллергеном вызывает кластеризацию клеточных рецепторов и запускает сигнальный каскад, приводящий к дегрануляции клеток. Высвобождение клеточных медиаторов, таких как гистамин, простогладины и цитокины, вызывают сокращение гладкой мускулатуры, зуд и отек.
In vitro диагностика аллергии I-го типа основана на выявлении аллерген-специфических антител класса Е в сыворотке крови. Точная и правильная постановка диагноза необходима для уточнения характера и причин аллергической реакции, а также выбора стратегии эффективного лечения.
Компоненты тест-системы в формате микрочипа
Для определения причин сенсибилизации аллергологами применяются различные подходы.
Для in vivo диагностики ингаляционной аллергии используют провокационные тесты - назальные, оральные или бронхиальные, для диагностики других типов аллергии применяют скарификационные, внутрикожные, а также кожные прик-тесты.
Открытие нового типа иммуноглобулинов класса Е во второй половине XX века и описание их роли в развитии реакций гиперчувствительности 1-го типа, позволило создать первые диагностические in vitro тест-системы [2]. Низкое содержание IgE в сыворотке крови и его пониженная аффинность, обусловили применение радиологического метода исследования - радиоаллергосорбентного теста (RadioAllergoSorbent Test, RAST) [3]. В современной диагностике нашла применение безопасная модификация RAST, в которых радиоактивная метка заменена хромогенной или флуоресцентной [6]. Формат первых RAST тестов и пришедших им на смену ИФА, подразумевал проведение анализа сыворотки на каждый индивидуальный аллерген в отдельности.
Платформа
Технология мирочипов (microarray) является высокопроцессивной платформой для проведения анализа по широким панелям маркеров. Впервые такие методы анализа были востребованы исследователями при конструировании кДНК и плазмидных библиотек [15]. Суть метода заключается в нанесении пиколитровых объемов образцов роботизированным образом на активированную подложку, формируя микроструктуру с плотностью элементов от 100 до 10 000 точек на квадратный сантиметр. Микрочип инкубируется с флуоресцентно-мечеными зондами, и после проведения гибридизации результат считывается на лазерном сканере.
Одним из критических элементов микрочип платформы является твердая фаза – субстрат, предназначенный для ковалентной иммобилизации биомолекул. В большинстве случаев субстрат представляет собой предметное микроскопное стекло высокого качества, поверхность которого модифицирована реактивными группами (альдегидные, эпокси и прочее).
При иммобилизации нуклеиновых кислот обычной схемой является формирование ковалентной связи между альдегидной группой поверхности и 5’-амино-модифицированным нуклеотидом. При создании белковых микрочипов процесс иммобилизации имеет ненаправленный характер, формирование связи идет случайным образом через аминокислотные остатки лизина, либо аргинина. В этом случае эффективность реакции зависит от множества факторов, таких как, наличие амино- групп на поверхности белка и их доступности, а также сохранение антигенной и функциональной структуры белка после иммобилизации.
Адаптация технологии микрочипов для белковых компонентов, позволила создавать тест-системы для применения в таких различных областях, как онкология, аллергология, аутоиммунная и инфекционная диагностика. Многочисленные публикации показывают, что аналитические свойства тест-систем на основе микрочипа сопоставимы с чувствительностью и специфичностью стандартных диагностических методов.
В настоящий момент на разных этапах разработки находятся несколько диагностических тест-систем, основанных на данном принципе: ImmunoCAP ISAC (Phadia); Biochip Immunoassays (Randox); Genarrayt Microarray 200+ Food IgG (Genesis Diagnostics); БИОЧИП (ИМБ РАН); Аллергочип (Алкор Био). Безусловным лидером в этой области является компания Фадия (Phadia AB., Sweden), применившая платформу микрочипа для потребностей аллергодиагностики - ImmunoCAP ISAC [14].
Аллергены
Термин «аллерген» широко используется при описании различных субстанций, вызывающих аллергическую реакцию – естественный источник аллергена, процессированный экстракт, либо очищенный белковый аллергенный компонент. В иммунологическом смысле «аллерген», это вещество, вызывающее развитие IgE-опосредованной иммунной реакции.
Основным компонентом любой диагностической тест-системы для выявления специфического IgE является аллерген. Изначально, основным путем их получения являлась холодная экстракция из природного материала. На протяжении всего 20-ого века шел активный процесс сбора и стандартизации аллергенных экстрактов из максимального количества источников. Однако, недостатками этого подхода можно признать:
1) Трудность стандартизации аллергенных экстрактов из-за естественной вариабельности состава активных компонентов и их изоформ в природных источниках (и как следствие, различная межлотовая чувствительность и специфичность);
2) Отсутствует возможность оптимизации баланса аллергенных компонентов в смеси (основной аллергенный компонент может присутствовать в экстракте в минорных количествах);
3) Присутствие «балластных» неаллергенных компонентов в экстракте может быть источником неспецифической реакции в анализе.
Было установлено, что некоторые аллергены проявляют высокую кросс-реактивность в пределах близкородственных и даже филогенетически далёких групп растений и животных [5]. Эволюционно консервативные белки, относящиеся к большим суперсемействам могут вызывать неспецифические реакции в аллергенных экстрактах. В состав природного аллергена обычно входят несколько аллергенных компонентов, которые проявляют различную иммуногенность у разных людей, формируя индивидуальный профиль чувствительности.
В последнее десятилетие возрастает понимание роли компонентной диагностики в правильности постановки диагноза, прогнозирования течения заболевания, профилактики и его терапии [2]. С появлением рекомбинантных технологий начался активный процесс создания синтетических форм аллергенных компонентов, а также очистка индивидуальных белков из цельных экстрактов. В ряде работ было показано, что замещение традиционного подхода, компонент-специфической аллергодиагностикой создает базу для качественно перехода in vitro тестирования из прогностической в клиническую область [8].
Детекция
Флуоресцентный краситель является самым распространенным типом метки в тест-системах на платформе микрочипа. Однако, это является и существенным ограничением повсеместного применения технологии микрочипов, т.к. возникает необходимость использования специального оборудования для считывания флуоресцентной метки. Стоимость сканера с требуемыми характеристиками колеблется в диапазоне 1,2-3 млн. рублей. При существующей децентрализованной практике проведения лабораторных исследований в России массовое оснащение подобным оборудованием лабораторий представляется затруднительным.
Использование ферментативной метки вместо флуоресцентной позволит заменить лазерный ридер на оптический планшетный сканер с широким динамическим диапазоном. Нами, при разработке аллергочипа, был реализован колориметрический способ детекции на основе конъюгата анти-IgE-пероксидаза хрена с преципитирующим субстратом. Результат оценивается денситометрически по интенсивности окрашивания. Этот способ позволяет существенно понизить стоимость анализа без значительной потери его чувствительности.
2. Материалы и методы.
Субстрат для иммобилизации
Печать микрочипов и иммобилизация аллергенов осуществлялись на альдегид-активированных субстратах, изготовленных по собственной технологии на основе микроскопных предметных стекол.
Аллергены
При создании макета тест-системы были использованы экстракты аллергенов производства компании «Алкор био» (Санкт-Петербург), полученные методом холодного экстрагирования.
Нами была подобрана панель образцов, состоящая из 15-ти аллергенов из разных групп:
1. d1 Клещ (Dermatophagoides pteronyssinus), 5 мг/мл;
2. d2 Клещ (Dermatophagoides farina), 4,1 мг/мл;
3. h1 Пыль домашняя (Greer Labs, Inc.), 7 мг/мл;
4. e1 Эпителий кошки (Felis domesticus), 2,7 мг/мл;
5. e2 Эпителий собаки (Canis familiaris), 2,6 мг/мл;
6. f1 Яичный белок, 9,4 мг/мл;
7. f2 Молоко коровье, 9,1 мг/мл;
8. f3 Треска (Gadus morhua), 8,2 мг/мл;
9. f35 Картофель (Solanum tuberosum), 9,1 мг/мл;
10. f75 Яичный желток, 8,8 мг/мл;
11. t3 Берёза бородавчатая (Betula verrucosa), 5 мг/мл;
12. t4 Лещина/орешник (Corylus avellana), 9,1 мг/мл;
13. w6 Полынь обыкновенная (Artemisia vulgaris), 5 мг/мл;
14. w8 Одуванчик (Taraxacum vulgare), 6,3 мг/мл;
15. m5 Кандида Candida albicans, 6,2 мг/мл.
Печать микрочипов
Экстракты 15 аллергенов были разведены в фосфатном буфере в двух концентрациях 20 и 50 мкг/мл и нанесены в дубликатах на субстрат при помощи роботизированной системы для бесконтактной печати Piezorray (Perkin Elmer). Нанесение производили на воздухе при температуре 22°С и влажности 40%. Объем пробы - 6 нл, размер точки - 400 мкм, расстояние между центрами элементов – 800мкм.
Сыворотки крови
Для проведения анализа нами было отобрано 15 сывороток с подтвержденным наличием специфических IgE и одна контрольная с низким уровнем общего IgE. Все образцы охарактеризованы в аллергосорбентном тесте по панели из 15 аллергенов с присвоением класса сенсибилизации.
Схема проведения анализа
После высыхания образцов на субстрате при комнатной температуре и влажности, стекла были отмыты от непрореагировавших белков. Для удаления остаточного иммобилизационного потенциала, субстраты обрабатывались блокирующим раствором с бычьим сывороточным альбумином. После тщательной отмывки, микрочипы были проинкубированы с исследуемыми образцами сывороток 3 часа при комнатной температуре. Тщательная отмывка и инкубация с конъюгатом антиIgE-пероксидаза хрена (Алкор Био) - 1,5 часа. Окраска прецепитирующим субстратом TMB (Sigma-Aldrich) до развития окраски.
Чипы сканировали на планшетном сканере Epson Perfection V500, разрешение - 600dpi. Обработку изображений и денситометрию результатов производили при помощи программы Gel-Pro Analyzer 3.1. Класс специфической сенсибилизации для каждого образца выставлялся исходя из величины оптической плотности точки микрочипа, причем значение рассчитывалось как среднее в дубликатах.
3. Результаты.
1. Морфология элементов микрочипа.
В результате ферментативной реакции на поверхность микрочипа преципитирует нерастворимый хромоген. Область окрашивания совпадает с геометрией точки нанесенного аллергена и представляет собой диск с диаметром 400мкм, однако внутренняя структура - «морфология» элемента может сильно различаться (рис.1). При высоких концентрациях спецIgE в образце, большее его количество связывается с аллергеном на фазе, и тем интенсивнее развивается окраска, при этом гомогенность точки высока. При невысоком уровне ответа, формируются структуры типа «бублик», либо элемент с размытыми краями.
2. Оценка корреляции результатов с данными АСТ.
В качестве отрицательного контроля была выбрана сыворотка человека с низким содержанием общего IgE. Результаты анализа данного образца показали фоновый уровень сигнала (рис.1). Образцы крови пациентов, имеющих в анамнезе аллергические заболевания и подтвержденные повышенные уровни спецIgE, показали наличие специфического ответа в разрабатываемой тест-системе.

Рис. 1. Результаты сканирования микрочипов после проведения анализа на примере двух пациентов. Для удобства восприятия на изображение наложена маска с подписями, где буквами обозначено сокращенное наименование аллергена, цифрами – его посадочная концентрация в мкг на мл. Образец №2319 – пациент имеющий специфическую сенсибилизацию на несколько аллергенов; №м4-649 – отрицательный контроль, пациент с низким уровнем общего IgE.
Оценка степени корреляции результатов анализа образцов на специфический IgE, полученных в аллергосорбентном тесте (АСТ) и на макете разрабатываемой тест-системы, была произведена с применением коэффициента ранговой корреляции Спирмена. Для обеих посадочных концентраций аллергена (20 и 50 мкг/мл) этот показатель высчитывался независимо. По 14-ти из 15-ти аллергенов разрабатываемая тест-система показала степень корреляции более 0,7 по отношению к референтной, что является показателем высокой степени связи. Средние значения коэффициентов корреляции для посадочных концентраций аллергенов 20 и 50 мкг/мл составили 0,792 и 0,860 соответственно.
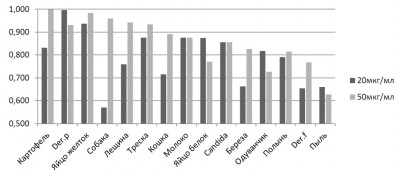
Рис. 2. Гистограмма значений коэффициента корреляции Спирмена по результатам анализа образцов сыворотки 16 пациентов по 15 аллергенам в АСТ тесте и макете тест-системы на платформе микрочипа. Ось абсцисс – наименование аллергенов; ось ординат – величина коэффициента.
4. Обсуждение.
В ходе выполнения данной работы нами был разработан макет тест-системы для полуколичественного определения уровня специфических IgE в сыворотке крови человека на платформе микрочипа. Для иммобилизации на фазе были использованы 15 экстрактов из различных аллергенных панелей. Проведенный анализ 16-ти образцов и сопоставление результатов с референтным методом АСТ путем оценки коэффициента Спирмена показали высокую степень корреляции методов. Однако, в ходе проведенных исследований были выявлены ряд ограничений на использование аллергенных экстрактов в тест-системе в формате микрочипа.
Морфология точек на микрочипе представлена в 3-ех различных вариантах – гомогенное заполнение площади хромогеном, формирование структур типа «бублик» и размытие границ с максимум интенсивности в центре. Дефекты структуры могут затруднять правильную интерпретацию результатов анализа. Было установлено, что сразу несколько факторов могут влиять на равномерную иммобилизацию аллергена. Внешние факторы – температура и влажность при нанесении образцов влияют на скорость испарения, что ведет к перераспределению концентрации белка в объеме капли, гидрофобные свойства субстрата – способствует формированию капли необходимой геометрии и удерживают ее форму. Основные внутренние факторы – наличие детергентов в составе водного раствора и суммарная концентрация белка.
В аллергосорбентном тесте аллергены пассивно сорбированы в лунках микропланшета. При инкубации с сывороткой, антитела связываются со специфическим аллергеном. Выявление образовавшихся комплексов происходит с использованием конъюгата анти-IgE - пероксидаза хрена. Недостатком данной схемы является то, что с аллергеном на твердой фазе связываются не только иммуноглобулины класса E, но и иммуноглобулины других классов, например, IgG, которые интерферируют с результатами теста.
Другой особенностью АСТ является снижение аналитических свойств системы при использовании аллергенных экстрактов с низким содержанием действующего аллергенного вещества. Большое количество «балластных» компонентов экстрактов, не несущих функциональной нагрузки, способно блокировать эффективную посадку целевого вещества. При использовании подобной схемы проведения анализа в формате микрочипа, лимитирующим фактором является малая ёмкость твердой фазы для иммобилизации аллергена, площадь которой составляет 1/1000 от активной площади лунки микропланшета.
При сопоставлении полученных данных по коэффициентам корреляции тест-систем для каждого аллергена с электрофореграммами используемых аллергенных экстрактов (данные не представлены), нашла подтверждение гипотеза о том, что повышенное содержание «балластных» веществ, препятствует эффективной иммобилизации аллергена на фазу.
Увеличение посадочной концентрации аллергенного экстракта с 20 до 50 мкг/мл приводит к росту среднего коэффициента корреляции тест-системы с 0,792 до 0,860 и повышению чувствительности анализа (рис.2). Дальнейшее увеличение концентрации не ведет к улучшению аналитических свойств, однако способствует формированию дефектных по морфологии точек.
Недостатки использования экстрактов
Аллергенные экстракты представляют собой смесь аллергенных и неаллергенных копмонентов. Для многих экстрактов доля «балластных» веществ может достигать 98-99% от общего количества белка. Под аллергеном обычно понимают смесь индивидуальных аллергенных компонентов, полученных из одного источника. Именно поливалентная природа аллергенов является основной причиной неверной интерпретации результатов in vitro дианостики.
Экстракты аллергенов могут иметь сходное биологическое действие, но различаться по своему составу, из-за гетерогенности натуральных источников, процесса производства экстрактов и нестабильности аллергенных белков. Часто бывает затруднительным дифференцировать истинную сенситизацию несколькими аллергенами от иммунологической кросс-реактивности.
Использование экстрактов может приводить к увеличению как ложноположительных результатов из-за присутствия компонентов с высокой кросс-реактивностью или загрязнения аллергенами из других источников, так и ложноотрицательных из-за отсутствия или деградации основных аллергенных белков в экстракте.
В основе кросс-реактивности антител лежит иммунологическое сходство аллергенных детерминант белков из разных аллергенных источников. На сегодняшний день гомологичными считают белки, схожие по аминокислотным последовательностям на 35 и более процентов. Основные группы таких белков –паналлергены, к которым относятся белки PR-10, профилины и полкальцины обнаруживаются как в близкородственных видах, так и филогенетически отдаленных. Самым известным примером является кросс-реактивность некоторых белков пыльцы с пищевыми аллергенами.
Компонент-специфическая диагностика
Развитие методов молекулярной аллергологии позволило выявить и охарактеризовать большинство основных аллергенных компонентов. В настоящее время идет активная работа по увеличению базы данных секвенированных последовательностей аллергенов (Allergome, AllFam и т.д.), и формированию панелей очищенных нативных и рекомбинантных аллергенов, что позволит их использовать для определения индивидуального профиля сенситизации для каждого пациента.
Синтетические аллергены требуют подробного исследования их физико-химических и иммунологических свойств, поскольку могут отличаться от своих натуральных аналогов. Рекомбинантные аллергены получают в различных экспрессионных системах (бактериях E.coli, дрожжах Pichia pastoris, клетках табака и насекомых), имеющих различные возможности для проведения посттрансляционных модификаций.Помимо прямого изучения профиля чувствительности пациента на аллергенные компоненты добавление рекомбинантных аллергенов в натуральные экстракты улучшает качество экстрактов с низким содержанием основных аллергенов.
Применение компонент-специфической диагностики позволяет отличить истинную аллергию на различные аллергены от реакций иммунологической кросс-реактивности.
Технология микрочипа представляет собой мощный инструмент для высокопроизводительного скрининга образцов. Область in vitro аллергодиагностики остро нуждается в подобном инструменте ввиду огромного разнообразия исследуемых маркеров.
5. Заключение
Наши исследования показали, что аналитические свойства разрабатываемой тест-системы в формате микрочипа удовлетворяют требованиям для полуколичественной оценки специфической IgE сенсибилизации. Полученные данные подтверждаются и в других исследованиях [12].
Для проведения исследования на микрочипе используются микролитровые объемы образца, что бывает критичным требованием при неонатальном скрининге. Себестоимость проведения серологического анализа на один аллерген в формате микрочипа на порядок меньше таковой для планшетного ИФА. Кроме того, использование колориметрической детекции вместо флуоресцентной, способно сделать диагностическую платформу более доступной для рутинного использования в медицинских учреждениях широкого профиля.
Список литературы.
1. Assing K., Bodtger U., Poulsen L.K., Malling H.J.//Allergy. -2007. -Vol. 62. -P. 373–377.
2. Asturias J.A., Ibarrola I., Amat P., Tella R., Malet A., Cisteró-Bahíma A., Enrique E., Malek T., Martínez A.//Clin. Exp. Allergy. -2006. -Vol. 36(12). -P. 1505-1512.
3. Berg T., Bennich H., Johansson S.G.//Int. Arch. Allergy Appl. Immunol. -1971. -Vol. 40(6). -P. 770-778.
4. Bodtger U., Poulsen L.K., Linneberg A.//Allergy. -2006. -Vol. 61. -P. 712–716.
5. Bonds R.S., Midoro-Horiuti T., Goldblum R.//Curr. Opin. Allergy. Clin. Immunol. -2008. -Vol. 8(1). -P. 82-86.
6. Eriksson N.E., Ahlstedt S.//Int. Arch. Allergy Appl. Immunol. -1977. -Vol. 54(1). -P. 88-95.
7. Fall B.I., Niessner R.//Methods Mol. Biol. -2009. -Vol. 509. -P. 107-122.
8. Goikoetxea M.J., Cabrera-Freitag P., Sanz M.L., Fernández-Benítez M.//Allergol. Immunopathol. (Madr). -2010. -Vol. 38(1). -P. 37-40.
9. Kay A.B. Allergy and Allergic Disease. -Oxford, 1997.
10. Sigurs N., Hattevig G., Kjellman B.//J. Allergy Clin. Immunol. -1994. -Vol. 94. -P. 757–763.
11. Kulig M., Bergmann R., Tacke U., et al.//Pediatr. Allergy Immunol. -1998. -Vol. 9. -P. 61–67.
12. Lebrun S.J., Petchpud W.N., Hui A., McLaughlin C.S.//J. Immunol. Methods. -2005. -Vol. 300(1-2). -P. 24-31.
13. Matricardi P.M., Illi S., Gruber C., et al.//Eur. Respir. J. -2008. -Vol. 32. -P. 585–592.
14. Phadia ImmunoCAP ISAC: [www.phadia.com].
15. Schena M., Shalon D., Davis R.W., Brown P.O.//Science. -1995. -Vol. 270(5235). -P. 467-70.